癌症免疫治療與原理
廖志穎醫師
放射腫瘤醫師/癌症輔助醫學
中國醫藥大學台中總院/質子中心(掛號)
SNQ國家品質標章:智慧整合輔助醫學
美國紐約MSKCC癌症整合醫學進修
休士頓MD ANDERSON癌症整合醫學進修
中國醫藥大學中西醫碩士
免疫系統原理:
人體的免疫系統,是由骨髓中的「血液幹細胞」製造出來的各式白血球組成,主要有兩大類,負責「先天性免疫」的「吞噬細胞」,和負責「特異性免疫」的「淋巴細胞」 。
吞噬細胞藉由辨識表現在微生物上的「病原體相關分子結構」而活化,活化的吞噬細胞將微生物的「抗原」呈獻給「T淋巴細胞」,刺激T淋巴細胞的活化。
活化的T淋巴細胞可經由血液系統和淋巴系統,巡邏全身,無論這些外來微生物(早期癌細胞、細菌、病毒等)躲在身體的哪個角落,都難逃免疫系統佈下的天羅地網。
癌細胞如何逃過免疫系統:
然而癌細胞不是省油的燈,藉由三階段演化的「免疫編輯理論」 躲過免疫系統的攻擊。
癌細胞如何逃過免疫系統:
然而癌細胞不是省油的燈,藉由三階段演化的「免疫編輯理論」 躲過免疫系統的攻擊。
人體內的癌細胞應該時時刻刻被免疫系統所監控。這就是有名的癌症「免疫監控」(immune surveillance)假說,最早是在1909年由諾貝爾獎得主艾 利奇(Paul Ehrlich)教授提出。 免疫監控假說有一個很大的漏洞,既然免疫系統能監控並攻擊癌細胞,為什麼癌細胞還有機會長成臨床上看到的大型腫瘤呢?
其實,癌細胞要在強大的人體免疫環境下生長,真是備極艱辛,只有經過無數次萃煉,最頑強、最能適應環境(也就是最能抵抗免疫攻擊)的癌細胞,才有機會存活下來。這種癌細胞進化過程,可以用達爾 文(Charles Darwin)對物種演化提出的「物競天擇,適者生存」的理論完美解釋。
其實,癌細胞要在強大的人體免疫環境下生長,真是備極艱辛,只有經過無數次萃煉,最頑強、最能適應環境(也就是最能抵抗免疫攻擊)的癌細胞,才有機會存活下來。這種癌細胞進化過程,可以用達爾 文(Charles Darwin)對物種演化提出的「物競天擇,適者生存」的理論完美解釋。
2001年希雷伯(Robert Schreiber)教授綜合過去的學說,提出癌症三階段演化的「免疫編輯理論」(immunoediting hypothesis):清除期、平衡期、逃逸期。
根據這個學說,初始生成的癌細胞抗原性強,很快就被免疫系統辨識並消滅了,這是癌症演化的第一期, 稱為「清除期」(elimination phase)。但因為癌細胞不斷的生成,基因突變也不斷累積,有些突變會造成抗原性降低,得以將癌細胞偽裝起來,得到生存下來的機會。這是癌症演化的第二期,稱為「平衡期」(equilibrium phase),這時盡管癌細胞不斷增殖,但免疫系統也能辨識和清除部分的癌細胞。
大部分人終生維持在這種癌症的平衡期,也就是體內雖然存在癌細胞,但因為有健全的免疫系統,最主要 是T淋巴細胞的監控,癌細胞不會長成臨床上看到的大腫瘤。
根據這個學說,初始生成的癌細胞抗原性強,很快就被免疫系統辨識並消滅了,這是癌症演化的第一期, 稱為「清除期」(elimination phase)。但因為癌細胞不斷的生成,基因突變也不斷累積,有些突變會造成抗原性降低,得以將癌細胞偽裝起來,得到生存下來的機會。這是癌症演化的第二期,稱為「平衡期」(equilibrium phase),這時盡管癌細胞不斷增殖,但免疫系統也能辨識和清除部分的癌細胞。
大部分人終生維持在這種癌症的平衡期,也就是體內雖然存在癌細胞,但因為有健全的免疫系統,最主要 是T淋巴細胞的監控,癌細胞不會長成臨床上看到的大腫瘤。
但是這種癌細胞和免疫系統的平衡狀態,會因為某 些基因突變使癌細胞演化出抑制T淋巴細胞攻擊的能力,因而進入癌症演化的第三期,稱為「逃逸期」(escape phase)。這個時期,少了免疫系統的監控,癌細胞就如脫韁野馬,快速增殖成大腫瘤,並藉由侵入微血管或淋 巴管轉移到其他器官。 因此,癌症根本就是由免疫系統訓練出來的殺手,它通過了免疫系統的重重考驗,對免疫系統具有強大 的抵抗力,很不幸地就成為我們在臨床上碰到的超強敵人。但必須強調的是,即使是在逃逸期的癌症病人, 體內仍然存在對癌細胞具專一性的T淋巴細胞,這些T淋巴細胞最常出現在腫瘤組織內。
2007年格蘭(Jérôme Galon)教授團隊總結了過去許多的臨床觀察,發表了一篇著名論文,提到當病人腫瘤組織存在越多的T淋巴細 胞,不論是接受手術、放射治療或化學治療,通常治療的效果越好,顯示病人的免疫系統在這些癌症的傳統治療,仍然扮演舉足輕重的角色。但為何這些腫瘤內的T淋巴細胞不能一舉將癌細胞殲滅呢?
第二部 癌免疫療法
早期免疫療法:
早期的免疫治療無法突破癌細胞構築的堅固防禦堡壘。 既然了解免疫系統可以有效辨識並攻擊癌細胞,科學家們開始發明各種藥物和方法,訓練免疫細胞用以治 療癌症,這類的治療稱為「癌症免疫治療」(cancer immunotherapy)。 前文曾提到,癌症治療最困難的部分是轉移癌,若癌細胞已經擴散到許多重要器官,傳統治療無法一一清 除這些分散各處的惡性細胞。有別於這些傳統的癌症治療,免疫治療訓練出來的抗癌T淋巴細胞,監控範圍遍及 全身。理論上,無論癌細胞轉移到何處,T淋巴細胞都能追蹤而至,消滅這些轉移的癌細胞。而早期比較著名的 有免疫藥物有:
一、干擾素(interferon):干擾素在1978年進行第一次臨床試驗,2011年被核准為臨床用藥(Sylatron™),用 以治療黑色素癌(melanoma)。
二、介白素2(interleukin 2):介白素2能活化T淋巴細胞和自然殺手細胞(natural killer cells,一種毒殺型細 胞,但不具抗原專一性),1985年羅森堡(Steven Rosenberg)教授用於治療黑色素細胞癌和腎細胞癌 (renal cell carcinoma),1992年被核准為臨床用藥(Proleukin)。
三、樹突細胞癌症疫苗(dendritic cell cancer vaccine):樹突細胞是一種吞噬細胞也是最重要的抗原呈現細 胞,能有效的活化T淋巴細胞。以樹突細胞和腫瘤抗原製造的癌症疫苗,對晚期的攝護腺癌有一定的療效, 2010年被核准為臨床用藥(Provenge)。
四、抗體藥物(antibody drugs):以免疫球蛋白(immunoglobulins)為主的抗體藥物,是近20年來最重要的 癌症治療藥物。抗體藥物的發明是奠基於幾項重大技術的突破,包括1975年柯勒(Georges Kohler)和密 爾斯坦(César Milstein)教授發明的「單株抗體」(monoclonal antibody)技術;1984年莫莉笙(Sherie Morrison)教授發明的「人鼠嵌合抗體」(mouse-human chimeric antibody)以及1986年文德(Greg Winter)教授發明的「擬人抗體」(humanized antibody)。最早使用抗體藥物治療人類癌症的先驅是李維 (Ronald Levy)教授,他的團隊研究促成了1997年被核准的CD20抗體(rituximab)藥物,該藥物對B细胞 淋巴瘤(B cell lymphoma)有顯著療效,是最早用來治療癌症的抗體藥物。但抗體藥物主要是藉由抑制癌 細胞特有的分子及異常的代謝途徑,嚴格來說是屬於癌症標靶治療(target therapy)的範疇,並非免疫治療。
但這些早期的免疫治療只對少數幾種癌症有部分療效,它和其他癌症的傳統治療一樣,很少能增加癌症病 人的長期存活率(overall survival)。也就是說,這些早期的免疫治療能夠延緩癌症病情,增加病人存活時間, 但無法治癒癌症,大部分病人最後還是死於癌症復發。
抑制免疫系統的主因-壞免疫微環境:
腫瘤微環境(tumor microenvironment) 為什麼癌症免疫治療無法發揮它應有的療效呢?這個問題困擾了科學家非常久,直到近幾年詳細研究癌細 胞所處的環境,稱為「腫瘤微環境」(tumor microenvironment),才有了初步的答案。科學家們發現,晚期癌症特有的大腫瘤,事實上是一個非常精巧和堅固的防禦工事,可以保護躲藏在腫瘤內的癌細胞,躲避免疫系統 的追殺。 過去我們認為腫瘤就是由癌細胞構成的組織,這種說法並不完全正確。腫瘤內除了有擔任主角的癌細胞 外,還有許多「內皮細胞」(endothelial cells)構成的新生血管,負責供應癌細胞生長所需的養分和氧氣。令 人訝異的是,腫瘤內部竟然還有許多的免疫細胞,將癌細胞層層包圍在內。但是,為什麼這些腫瘤內的免疫細 胞,不能阻止腫瘤的生長和轉移呢? 原來這些腫瘤內的免疫細胞,包括「腫瘤相關性巨噬細胞」(tumor-associated macrophages,TAM)、 「腫瘤相關性嗜中性粒細胞」(tumor-associated neutrophils,TAN)和「調節T細胞」(regulatory T cells, Treg),雖然也是由血液幹細胞製造出來的,但已經被癌細胞徹底改造成【壞免疫細胞】。
 |
| 待在腫瘤旁的淋巴球,與預後有關 |
研究發現,癌細胞能分泌一些特 別的分子,吸引血液中的免疫細胞進到腫瘤內,並且將它們改造為「抑制型免疫細胞」(immune suppressor cells)。 顧名思義,這些腫瘤內的抑制型免疫細胞不僅喪失了引發免疫反應的功能,而且還會抑制免疫反應,扮演癌症禁衛軍的角色,負責保護癌細胞抵抗T淋巴細胞的攻擊。
最近科學家們將腫瘤內的T淋巴細胞分離出來, 利用「微陣列」(microarray analysis)技術分析它們的基因表現,證明這些腫瘤內的T淋巴細胞處於失能狀態 (exhausted phenotype),已經完全不具攻擊力了。免疫治療的重點,在刺激病人的免疫系統,生產T淋巴細胞 攻擊腫瘤。但這些具腫瘤專一性的T淋巴細胞,一但進入了腫瘤,馬上被抑制型免疫細胞包圍繳械,使之失去戰 鬥力,這就解釋了為何過去免疫治療大多失敗的原因。 因此,腫瘤內存在的抑制免疫反應的微環境,是癌細胞有恃無恐的最大原因,近年來的研究已經將這 個抑制機制的神秘面紗,逐漸揭露。原來,抑制型免疫細胞會透過和T淋巴細胞表面的「抑制型受體分子」 (inhibitory receptors)作用,引起T淋巴細胞的失能或「凋亡」(apoptosis)。T淋巴細胞上,最重要的抑制 型受體分子有CTLA-4(cytotoxic T lymphocyte-associated protein 4, CD152)和PD-1(programmed cell death protein 1, CD279),缺少T淋巴細胞的保護,癌細胞就能高枕無憂的大量繁殖了。
癌症免疫治療的大突破 由於對腫瘤微環境的研究,讓科學家們了解,要讓免疫治療發揮臨床效果,除了要產生大量的、具腫瘤專 一性的T淋巴細胞外,還要能控制腫瘤的免疫抑制環境,使這些T淋巴細胞,發揮毒殺腫瘤的功能。以此學理 設計的新一代免疫藥物,終於有了突破性的進展,對部分現行療法難以治癒的晚期癌症病人取得顯著的治療 效果,並能長期控制癌症防止復發。這在癌症治療領域,是劃時代的躍進。因此,癌症免疫治療被「科學」 (Science)期刊,選為2013年的最重大科學突破。
現階段最新的免疫療法
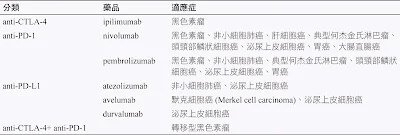
一.免疫檢查點抑制劑-藥物免疫
癌細胞發展出CTLA-4和PD-1,像踩剎車般讓T淋巴細胞失去功能,因此以藥物免疫使用單株抗體阻斷CTLA-4或PD-1的 作用,理論上應該能恢復T淋巴細胞的抗癌功能,這就是目前最熱門的免疫檢查點抑制劑的作用原理了。
PD-1抗體 1999年,日本的本庶佑(Tasuku Honjo)教授發現PD-1,是表現在活化T淋巴細胞上的一種抑制型受體分 子。兩年後,發現了能和PD-1結合的PD-L1(programmed death-ligand 1,CD274)分子,表現在癌細胞本身或腫瘤內的TAM和TAN等抑制型免疫細胞上。因為腫瘤微環境內有大量的PD-L1表現,透過和PD-1 的結合,是導致 T淋巴細胞失去功能的主要原因。 2012年,约翰霍普金斯大學(The Johns Hopkins University)醫療團隊,在同一期的新英格蘭醫學雜誌 (New England Journal of Medicine),發表了兩篇劃時代的論文。團隊使用PD-L1抗體;阻斷腫瘤微環境中PD-1和PD-L1對T淋巴細胞的抑制功能。結果同時發現,這兩種抗體藥物,不但能治療黑色素細胞癌,也對肺癌有顯著療效。 這個成果太震撼了,因為過去的免疫治療大多只能用來治療黑色素細胞癌,對一些更常見的癌症幾乎沒有 什麼效果。但PD-1和PD-L1抗體卻能對癌症中發生率和死亡率最高的肺癌有療效,這種抗癌藥物能夠發揮的醫療 效果當然也就更大了。美國食品藥物管理局(US Food and Drug Administration,FDA)很快的在2014年核准了 兩種PD-1抗體(nivolumab和pembrolizumab)用於治療黑色素細胞癌,2015年核准用於治療肺癌。後續的臨床 研究甚至發現,PD-1抗體對其它更多種類的癌症也都有效肝癌、頭頸癌、泌尿上皮癌、食道癌等,2017年核准用於治療所有的轉移癌。
PDL1藥物 Durvalumab 抑癌寧 Atezolizumab癌自禦
CTLA-4最早是在1987年發現的抑制型受體分子,T淋巴細胞平常並不表現CTLA-4,但在T淋巴細胞活化後, CTLA-4很快的會表現在細胞膜上,抑制T淋巴細胞過度活化,因此CTLA-4的正常生理功能是扮演類似T淋巴細胞 的煞車機制。
2002年 MD Anderson艾立森(James Allison)教授開始的初期臨床試驗證明CTLA-4抗體可以治療人類的黑色素細胞癌。
2010年何帝(Stephen Hodi)醫師發表 了一篇震驚醫界的重要論文,發現CTLA-4抗體可以顯著延長黑色素細胞轉移癌病人的存活率。在1,861位長期追蹤的病人,有超過 20%的人10年後還存活著,非常可能,CTLA-4抗體已經治癒這些病人的黑色素細胞癌了。
CTLA-4抗體 (ipilimumab)在2011年被核准為臨床用藥,用來治療轉移的黑色素細胞癌病人。CTLA-4抗體也開始用於其他癌症的治療,包括肺癌、肝癌、和大腸癌、食道癌、腎臟癌、黑色素細胞癌或是合併雙免疫PD1療法。
CTLA-4抗體的副作用較高,大約30%的病人會出現免疫系統過度活化相關的副作用,主要發生在胃腸道和 皮膚,所幸大部分的副作用可以用皮質類固醇(corticosteroids)和其他抗發炎藥物加以控制。
CTLA4藥物Ipilimumab 益伏
目前雙免疫療法:PD1+CTLA4藥物合併療法,使用兩個機轉的免疫藥物治療,在過往的困難治療個案,產生重大的治療突破:肝癌、食道癌、腎細胞癌、間皮瘤等。
A、PD-1/PD-L1 抑制劑的副作用
1. 皮膚相關皮疹:出現紅斑、丘疹等。
搔癢(瘙癢):皮膚感到發癢不適。
2. 消化系統腸炎:包括腹痛、腹瀉,嚴重者可能出現腸穿孔。
肝炎:肝功能指標升高,出現黃疸等症狀。
3. 內分泌系統甲狀腺功能異常:包括甲狀腺功能亢進或低下。
腎上腺功能不全:如腎上腺皮質功能低下。
下垂體炎(腦下垂體功能障礙):導致激素分泌異常。
4. 呼吸系統肺炎:症狀包括咳嗽、呼吸困難等。
5. 其他系統關節炎:關節疼痛、腫脹。
腎炎:腎功能受損。
神經系統:罕見情況下可能出現神經炎症。
B、CTLA-4 抑制劑的副作用
CTLA-4 抑制劑(如伊匹單抗,Ipilimumab)通常與 PD-1/PD-L1 抑制劑相比,具有更高的免疫相關不良反應風險。其常見副作用包括:
1. 皮膚相關嚴重皮疹:廣泛性紅疹、水泡等。
搔癢:強烈的瘙癢感。
2. 消化系統嚴重腸炎:包括劇烈腹痛、持續性腹瀉,可能需要停藥並使用免疫抑制劑治療。
3. 內分泌系統垂體炎:下垂體功能受損,導致多種激素缺乏。
甲狀腺功能異常:類似 PD-1/PD-L1 抑制劑的甲狀腺問題。
4. 呼吸系統嚴重肺炎:可能需要緊急治療。
5. 其他系統肝炎:肝功能顯著異常。
腎炎:腎功能顯著受損。
神經系統:罕見但嚴重的神經炎症。
C、副作用的管理早期識別:
患者和醫護人員需密切監測出現的症狀,及早識別免疫相關不良反應。
停藥:對於嚴重副作用,可能需要暫停或終止免疫治療。
免疫抑制治療:如使用皮質類固醇來抑制過度的免疫反應。
對症治療:根據具體症狀進行相應治療,如激素替代療法治療內分泌異常。
停藥:對於嚴重副作用,可能需要暫停或終止免疫治療。
免疫抑制治療:如使用皮質類固醇來抑制過度的免疫反應。
對症治療:根據具體症狀進行相應治療,如激素替代療法治療內分泌異常。
D、總結
PD-1/PD-L1 和 CTLA-4 抑制劑在治療多種癌症中展現出顯著的療效,但也伴隨著一定風險的免疫相關副作用。患者在接受這類治療前,應詳細了解可能的副作用,並在治療過程中與醫療團隊保持密切聯繫,以便及時處理任何不良反應,確保治療的安全性和有效性。
PD-1/PD-L1 和 CTLA-4 抑制劑在治療多種癌症中展現出顯著的療效,但也伴隨著一定風險的免疫相關副作用。患者在接受這類治療前,應詳細了解可能的副作用,並在治療過程中與醫療團隊保持密切聯繫,以便及時處理任何不良反應,確保治療的安全性和有效性。
細胞療法
一、細胞輸入療法新一代的免疫治療,主要有兩大類:包括以基因改造T細胞治療為主的「CART細胞療法」和自體免疫細胞療法(DC、DC-CIK、CIK、GDT)。
T細胞輸入療法的原理,是利用「基因工程」(genetic engineering)技術改造病人自己的T細胞基因,使之具有辨識腫瘤專一性,稱為「嵌合受體T細胞」(chimeric antigen receptor, CAR-T cells)。將這些十、 百億計的CAR-T細胞打回病人體內。 這種療法是以量取勝,使用大量活化的T細胞克服癌症的免疫抑制環境,在「急性淋巴性白血病」(acute lymphoblastic leukemia,ALL)及其他血液相關癌症有非常顯著的療效。2017年4月CAR-T細胞首次取得藥證, 用於治療「瀰漫型大B細胞淋巴瘤」(diffuse large B cell lymphoma)。 CAR-T細胞目前僅用於治療血癌,對其他常見癌症的治療效果並不好。主要原因是,其他癌症缺少腫瘤專一 性抗原,而使用T細胞輸入療法時需打入大量的CAR-T細胞,必須確保其他正常組織不會表現CAR-T細胞辨識的腫瘤抗原;否則,CAR-T細胞除了攻擊癌細胞外也會波及正常細胞,造成許多和免疫系統過度活化相關的副作 用。例如「細胞激素釋放症候群」(cytokine release syndrome)和「細胞激素風暴」(cytokine storm),嚴重 時會導致病人死亡。另外,治療時必須為每個病人特製自己的CAR-T細胞,預期藥價會非常昂貴。
台灣癌症基金會
主要的自體免疫細胞療法有:
1.樹突細胞治療(Dendritic Cells,DC)
DC治療「第一至第三期實體癌」經標準治療無效
DC治療「實體癌第四期」
適應症:多型性膠質母細胞瘤及續發性腦瘤(腦轉移癌)、肝癌、大腸直腸癌、乳癌、胰臟癌、上皮性卵巢癌、攝護腺癌、頭頸癌
2.樹突細胞結合細胞因子誘導殺手細胞
(Dendritic Cell/cytokine-induced killer cell , DC-CIK)
DC-CIK治療「實體癌第四期」
適應症:肝癌、肺癌、大腸直腸癌、乳癌、上皮性卵巢癌、腎細胞癌、食道癌、胃癌
3.細胞激素誘導型殺手細胞治療(Cytokin-induced killer,CIK)
CIK治療「第一期至第三期實體癌」經標準治療無效」
適應症:上皮性卵巢癌、肺癌、肝癌、乳癌、大腸直腸癌、胰臟癌。
CIK治療「實體癌第四期」
適應症:實體癌第四期;癌症別:多型性膠質母細胞瘤、上皮性卵巢癌、肺癌、肝癌、乳癌、大腸直腸癌、胰臟癌、泌尿上皮細胞癌。
DC-CIK治療「實體癌第四期」
適應症:肝癌、肺癌、大腸直腸癌、乳癌、上皮性卵巢癌、腎細胞癌、食道癌、胃癌
3.細胞激素誘導型殺手細胞治療(Cytokin-induced killer,CIK)
CIK治療「第一期至第三期實體癌」經標準治療無效」
適應症:上皮性卵巢癌、肺癌、肝癌、乳癌、大腸直腸癌、胰臟癌。
CIK治療「實體癌第四期」
適應症:實體癌第四期;癌症別:多型性膠質母細胞瘤、上皮性卵巢癌、肺癌、肝癌、乳癌、大腸直腸癌、胰臟癌、泌尿上皮細胞癌。
參考資料:中國醫藥大學附設醫院細胞療法中心
放射線治療一直是癌症的標準治療方法,放射線不但可以殺死癌細胞,釋放大量的腫瘤抗原;同時,局部放射治療也會殺死腫瘤周圍的抑制型免疫細胞(Treg),破壞腫瘤的免疫抑制微環境。此時,如果合併免疫營養素提升淋巴球活性、免疫藥物吸引新的T淋巴細胞進到腫瘤內,在沒有抑制性免疫細胞的環境下,具腫瘤專一性的T淋巴細胞將能大量增生, 或是自體細胞免疫大軍,徹底消滅原位癌。
未來明星-組合醫療
組合醫療(combination therapy)才是癌症治療的王道。
癌症免疫治療是利用活化病人的免疫系統來治療癌症,和傳統癌症治療最大的差別,在於免疫治療產生的抗癌T淋巴 細胞,能區分癌細胞和正常細胞的微小差異,專一且有效率的攻擊癌細胞,因此通常療效好且副作用小。更重要的是,因為T淋巴細胞具有記憶性和自我複製能力,可以在病人體內源源不斷的產生,能達到長期控制或清除 癌細胞的效果,使癌症變成可以「治癒」的疾病。
當然,這只是一個癌症醫療新時代的開始,還有許多問題有待克服。諸如為什麼免疫檢查點抑制劑只對少 數病人有療效?是否有適當的生物標記(biomarkers)來幫助醫師篩選最可能受益的病人?因為免疫治療通常會伴隨免疫系統過度活化相關的副作用,有些甚至相當嚴重,如果免疫治療對控制病人的癌症沒有幫忙,那就不值得冒這個風險了。另外,癌症免疫治療目前的價格非常昂貴,更需要有選擇的用在可能受益的病人。 饒有前景的免疫藥物和放射線的組合治療 目前最受期待的癌症免疫藥物「免疫檢查點抑制劑」,事實上只對少數約20%的癌症病人有效。因此如何運用免疫營養、輔助療法增強免疫治療療效使更多病人受益,是未來癌症治療的重要挑戰。
許多動物和臨床資料顯示,決定癌症免疫治 療療效最重要的關鍵,在於活化腫瘤專一性T淋巴細胞和減少腫瘤微環境中的抑制性免疫細胞。依此原理設計免 疫治療並搭配其它的癌症療法,或許能進一步提高癌症的治療效果。
 |
| 放療搭配免疫療法 |
放射線治療一直是癌症的標準治療方法,放射線不但可以殺死癌細胞,釋放大量的腫瘤抗原;同時,局部放射治療也會殺死腫瘤周圍的抑制型免疫細胞(Treg),破壞腫瘤的免疫抑制微環境。此時,如果合併免疫營養素提升淋巴球活性、免疫藥物吸引新的T淋巴細胞進到腫瘤內,在沒有抑制性免疫細胞的環境下,具腫瘤專一性的T淋巴細胞將能大量增生, 或是自體細胞免疫大軍,徹底消滅原位癌。